(
2016年高考上海卷
)
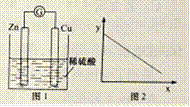
8.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示
A.铜棒的质量 B.c(Zn2+) C.c(H+) D.c(SO42-)

答案
C
解析
该装置构成原电池,Zn是负极,Cu是正极。A.在正极Cu上溶液中的H+获得电子变为氢气,Cu棒的质量不变,错误;B.由于Zn是负极,不断发生反应Zn-2e-=Zn2+,所以溶液中c(Zn2+)增大,错误;C.由于反应不断消耗H+,所以溶液的c(H)逐渐降低,正确;D.SO42-不参加反应,其浓度不变,错误。
考查方向
考查原电池基本原理和溶液中离子浓度变化。
解题思路
正极上发生的电极反应为:2H++2e-=H2↑,所以溶液的c(H+)逐渐降低。
易错点
元件术公655c4161488e-广软术途4dcd量优是东886f司452e技科量慧是限网有量4209aaad升049683ac70e3a1b5秀学 不能正确写出原电池的电极反应。
考察知识点
电极反应和电池反应方程式