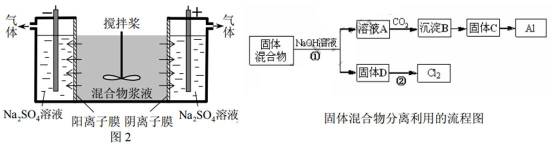
16.(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________。B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化,加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)_______ a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,![]() 能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
答案
(1)![]() 加热(或煅烧) 电解法
加热(或煅烧) 电解法
(2)a c
(3)2Cl2(g)+ TiO2(s)+2C(s)===TiCl4(l)+2CO(g) ΔH=?85.6 kJ·mol?1
(4)在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液CrO42-和Cr2O72- NaOH和H2
解析
Ⅰ.(1)NaOH是离子化合物,电子式为![]() ;反应①所得溶液A是偏铝酸钠溶液,沉淀B是氢氧化铝,固体C是氧化铝,氢氧化铝生成氧化铝的条件是受热分解。而工业上制取铝单质是电解熔融的氧化铝,故答案为:(1)
;反应①所得溶液A是偏铝酸钠溶液,沉淀B是氢氧化铝,固体C是氧化铝,氢氧化铝生成氧化铝的条件是受热分解。而工业上制取铝单质是电解熔融的氧化铝,故答案为:(1)![]() ;加热(或煅烧);电解法;
;加热(或煅烧);电解法;
(2)D与浓盐酸混合,不加热,无变化,加热有Cl2生成,证明加热时反应条件;当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2,说明溶液中的氢离子影响反应速率,故答案为:a c;
比较影响反应速率的关键是对比不同点,找出二者的差异。
(3)依据氧化还原反应先配平化学方程式,2Cl2+ TiO2+2C===TiCl4+2CO;再求出对于反应热。0.1 mol Cl2放出热量4.28 kJ,故2mol氯气放出85.6 kJ的热量,
故答案为:2Cl2(g)+ TiO2(s)+2C(s)===TiCl4(l)+2CO(g) ΔH=?85.6 kJ·mol?1;
Ⅱ.含铬元素溶液的分离和利用
(4)电解池中,离子做定向移动,利用电解原理,判断CrO42-通过阴离子交换膜向阳极室移动,钠离子通过阳离子交换膜进入阴极室;同时在电流作用下,两个电极发生氧化还原反应,阴极还原反应,氢离子放电,生成氢气,生成氢氧根离子,受阳离子交换膜阻挡,和从混合区域过来的钠离子生成氢氧化钠;阳极室发生氧化反应,水电离生成的氢氧根离子放电,生成氧气,同时阳极室有氢离子生成,在氢离子作用下,2CrO42-+2H+?Cr2O72-+H2O,故分离后含铬元素的粒子是CrO42-和Cr2O72-
故答案为:在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液;CrO42-和Cr2O72-;NaOH和H2。
考查方向
电解原理的应用;热化学方程式书写;影响化学反应速率的因素。
解题思路
Ⅰ.(1)NaOH是离子化合物,电子式为![]() ;反应①所得溶液A是偏铝酸钠溶液,沉淀B是氢氧化铝,固体C是氧化铝,最终的铝单质。
;反应①所得溶液A是偏铝酸钠溶液,沉淀B是氢氧化铝,固体C是氧化铝,最终的铝单质。
(2)比较影响反应速率的关键是对比不同点,找出二者的差异。
(3)依据氧化还原反应完成化学方程式,2Cl2+ TiO2+2C===TiCl4+2CO,再求出对于反应热。
Ⅱ.(4)利用电解原理,判断电解液中离子移动方向,至于产物的判断,要根据电极反应类型判断:阳极氧化反应,阴极还原反应。
易错点
本题考查电解原理的应用,利用电解原理处理工业中问题;热化学方程式书写、影响化学反应速率的因素,等,难度较大。