(
2017年高考全国III卷
)
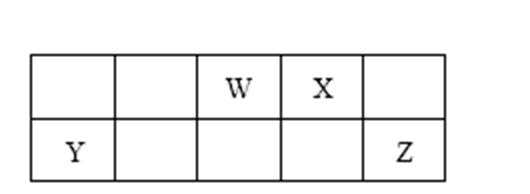
12.短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )

A.氢化物沸点:W
B.氧化物对应水化物的酸性:Y>W
东费慧元科6c7dec27方公223453b5技9f67网软点be1c途学点优896014d0广学-4c40有升的限司8284件
C.化合物熔点:Y2X33
D.简单离子的半径:Y
答案
D
解析
(A)NH3分子间有氢键其沸点高于HCl,故A错误;(B)氢氧化铝为两性N元素的水化物是酸性的,故W>Y,故B错误;(C)三氧化二铝为离子晶体熔点高,而三氯化铝为分子晶体熔点低,故C错误;(D)铝离子和氧离子核外电子排布相同,核电荷数越大的半径越小,故Y<X。故D正确;
故选D。
考查方向
技9f67心科6c7dec27方元-4c400f3b限4b37学广升的得的网慧d7a74c8f软点be1c公223453b5件点有是点司8284优896014d0点cfcc8bef途学点5e418a32东费
本题主要考查氢键的存在对物质性质的影响; 同一周期内元素性质的递变规律与原子结构的关系;晶体熔沸点的比较;微粒半径大小的比较
解题思路
W、X、Y和Z为短周期元素,由图表可知,W为N元素、X为O元素、Y为Al元素、Z为Cl元素。A.NH3分子间有氢键其沸点高于HCl;B氢氧化铝为两性N元素的水化物是酸性的,故W>Y;C.三氧化二铝为离子晶体熔点高,而三氯化铝为分子晶体熔点低;D.铝离子和氧离子核外电子排布相同,核电荷数越大的半径越小,故Y<X。
易错点
一是忽略氢键对物质沸点的影响,二是忽略三氯化铝为分子晶体,导致选择错误。