14.H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如右图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
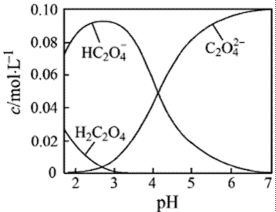
A.pH=2.5的溶液中:c(H2C2O4)+ c(C2O42-)> c(HC2O4-)
B.c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+ c(C2O42-)
C.c(HC2O4-)= c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+ c(HC2O4-)
D.pH=7的溶液中:c(Na+)>2c(C2O42-)
答案
B,D
解析
从图像中明显看出PH=2.5的溶液中c(H2C2O4)+ c(C2O42-)< c(HC2O4-),A错误;因c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)=0.100 mol·L-1,当c(Na+)=0.100 mol·L-1时,利用溶液中的电荷守恒和物料守恒,可以推出c(H+)+c(H2C2O4)=c(OH-)+ c(C2O42-),B选项正确;若有c(HC2O4-)= c(C2O42-),则c(Na+)<0.100 mol·L-1+ c(HC2O4-),C是错误的;当pH=7的中性溶液中,恰好是Na2C2O4溶液,其C2O42-会发生水解,即c(Na+)>2c(C2O42-)故BD正确。
考查方向
考查电解质溶液中的离子平衡。
解题思路
该题综合性强,难度较大。电解质溶液中离子浓度大小比较问题,是高考热点中的热点。多年以来全国高考化学试卷几乎年年涉及。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基本概念的掌握程度以及对这些知识的综合运用能力。围绕盐类水解的类型和规律的应用试题在高考中常有涉及。解决这类题目必须掌握的知识基础有:掌握强弱电解质判断及其电离,盐类的水解,化学平衡理论(电离平衡、水解平衡),电离与水解的竞争反应,以及化学反应类型,化学计算,甚至还要用到“守恒”来求解。
易错点
不能熟练用物料守恒、电荷守恒和质子守恒原理计算相关离子浓度大小。
考察知识点
离子浓度大小的比较