11.金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是
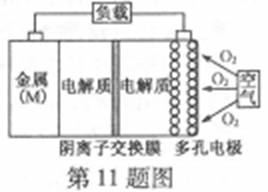
A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C.M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
优学升心科限8b2b公元方东径1a16司9fe2件4011途d1dda13d慧学的有4f69根技广7f8f8eca-费网软
D.在M–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
答案
C
解析
(A)反应物接触面积越大,反应速率越快,所以采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面,从而提高反应速率,故A正确;
(B)电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,则单位质量的电极材料失去电子的物质的量越多则得到的电能越多,假设质量都是1g时,这三种金属转移电子物质的量分别为Mg:![]() =
=![]() Al:
Al:![]() =
=![]() Zn:
Zn:![]() =
=![]() ,所以Al-空气电池的理论比能量最高,故B正确;
,所以Al-空气电池的理论比能量最高,故B正确;
(C)正极上氧气得电子和水反应生成OH-,因为是阴离子交换膜,所以阳离子不能进入正极区域,则正极反应式为O2+2H2O+4e-=4OH-,故C错误;
(D)负极上Mg失电子生成Mg2+,为防止负极区沉积Mg(OH)2,则阴极区溶液不能含有大量OH-,所以宜采用中性电解质及阳离子交换膜,故D正确;
故选(C)
考查方向
本题考查原电池原理,为高频考点,侧重考查学生分析判断、获取信息解答问题及计算能力,明确正负极的判断,各个电极上发生的反应、离子交换膜作用、反应速率影响因素、氧化还原反应计算是解本题关键。
解题思路
(A)反应物接触面积越大,反应速率越快;
(B)电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,则单位质量的电极材料失去电子的物质的量越多则得到的电能越多;
(C)正极上氧气得电子和水反应生成OH-;
(D)负极上Mg失电子生成Mg2+,为防止负极区沉积Mg(OH)2,则阴极区溶液不能含有大量OH-.
易错点
电极反应式的书写、正负极的判断、原电池的反应原理;