26.(14分)
水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
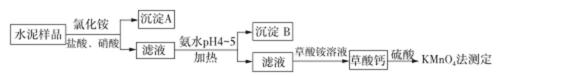
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(写化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:![]() +H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L−1的KMnO4溶液36.00
mL,则该水泥样品中钙的质量分数为______________。
+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L−1的KMnO4溶液36.00
mL,则该水泥样品中钙的质量分数为______________。
答案
(1)将样品中可能存在的Fe2+氧化为Fe3+ H2O2
(2)SiO2 (或H2SiO3) SiO2+4HF=SiF4↑+2H2O(或H2SiO3+4HF= SiF4↑+3H2O)
(3)防止胶体生成,易沉淀分离 Fe(OH)3 Al(OH)3
(4)45.0%
解析
(1)在分解水泥样品过程中加入硝酸是将分解产生的Fe2+转化为Fe3+ ,便于后续的沉淀处理;加入硝酸的目的是将Fe2+氧化为Fe3+ ,所以可以用H2O2溶液代替硝酸进行氧化处理,无污染且不产生其他杂质
(2)沉淀A是水泥中不溶于硝酸与盐酸的成分,所以A的主要成分为SiO2 ,SiO2 可与氢氟酸发生反应,此反应的方程式为SiO2+4HF=SiF4↑+2H2O
(3)在加氨水的过程中升高温度是为了加快反应速率,防止胶体生成,促进沉淀的生成,易于分离;沉淀B是在PH为4~5时产生的沉淀,根据难溶碱的沉淀PH,可知沉淀B的主要成分是Fe(OH)3 、 Al(OH)3。
(4)根据反应的离子方程式可得到2![]() ~5H2C2O4,同时Ca2+~H2C2O4,则样品中钙的质量分数
~5H2C2O4,同时Ca2+~H2C2O4,则样品中钙的质量分数![]()
考查方向
硝酸的化学性质, 硅和二氧化硅、化学方程式的书写, 盐类水解的应用, 定量研究的方法、元素质量分数的计算、探究物质的组成或测量物质的含量
解题思路
(1)在分解水泥样品过程中加入硝酸是将分解产生的Fe2+转化为Fe3+ ,便于后续的沉淀处理;一般工业流程中铁元素最终都转化为Fe(OH)3 。一般都是氧化,再调PH为4~5。所以可以用H2O2溶液代替硝酸进行氧化处理,无污染且不产生其他杂质
(2)沉淀A是水泥中不溶于硝酸与盐酸的成分,所以A的主要成分为SiO2 ,SiO2 可与氢氟酸发生反应,此反应的方程式为SiO2+4HF=SiF4↑+2H2O
(3)在加氨水的过程中升高温度是为了加快反应速率,防止胶体生成,促进沉淀的生成,易于分离;沉淀B是在PH为4~5时产生的沉淀,根据难溶碱的沉淀PH,可知沉淀B的主要成分是Fe(OH)3 、 Al(OH)3。
(4)根据反应的离子方程式可得到2![]() ~5H2C2O4,同时Ca2+~H2C2O4,则样品中钙的质量分数
~5H2C2O4,同时Ca2+~H2C2O4,则样品中钙的质量分数![]()
易错点
本题主要考查的是化工流程题的杂质分离和产物的最终形成。加试剂一般都是通过过滤的方式分离。计算时要把握一个守恒思想,利用方程式将已知量和未知量建立关系